Chưa có sản phẩm trong giỏ hàng.
Kiến thức
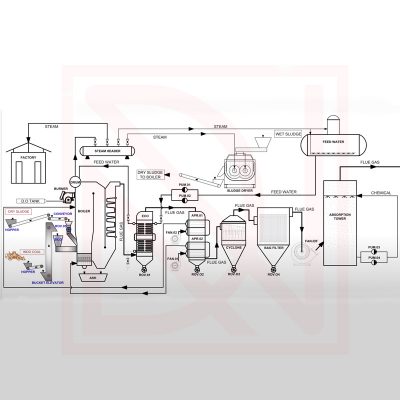
Xử lý khí thải lò hơi đốt rác
Thiết kế hệ thống xử lý khí thải như thế nào?
Việc thiết kế hệ thống khí thải phải đảm bảo sao cho khói thải lò hơi được kiểm soát để thỏa mãn tiêu chuẩn về khói thải ra ngoài môi trường.
Dựa vào thành phần nhiên liệu đốt của lò hơi ta có thể tính được nồng độ các chất thải ra môi trường sau đó tra bảng nồng độ các chất cho phép theo QCVN 30:2012/BTNMT lò đốt chất thải công nghiệp hoặc các tiêu chuẩn khác tương đương hoặc nghiêm ngặt hơn.
Hệ thống xử lý khói thải sẽ phải đơn giản với chi phí thấp và các thiết bị hoạt động với hiệu suất cao. Phương pháp xử lý khói thải của các nhà máy đốt rác sản xuất điện trên thế giới thường chia thành 3 hệ thống nhỏ là hệ thống Cyclone, hệ thống lọc bụi túi và hệ thống hấp thụ.
Nồng độ C của vụi và các chất vô cơ làm cơ sở tính nồng độ tối da cho phép trong khí thải công nghiệp QCVN 30:2012/BTNMT:
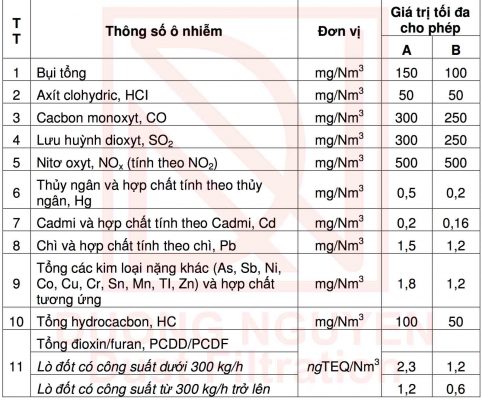
Trong đó:
- Cột A áp dụng đối với tất cả các lò đốt CTCN cho đến ngày 31 tháng 12 năm 2014;
- Cột B áp dụng đối với tất cả các lò đốt CTCN kể từ ngày 01 tháng 01 năm 2015.
CÁC CHẤT Ô NHIỄM TRONG KHÓI THẢI LÒ HƠI:
- Lò hơi đốt rác: Khói + tro bụi + COx + NOx + SOx
- Lò hơi đốt bằng củi : Khói + tro bụi + CO +CO2
- Lò hơi đốt bằng than: Khói + tro bụi + CO +CO2 + SO2 +SO3 + NOx
- Lò hơi đốt bằng dầu F.O: Khói + tro bụi + CO +CO2 + SO2 +SO3 + NOx

Để Xử Lý Các Chất Khói + tro bụi + COx + NOx + SOx .. v.v.. Ta Làm Thế Nào?
Bây giờ chúng ta đi sâu vào việc làm thế nao để xử lý Khói + tro bụi + CO +CO2 + SO2 +SO3 + NOx:
- Chúng ta sẽ lọc những hạt bụi có kích thước lớn qua hệ thống Cyclone đa cấp.
- Lọc những hạt bụi có kích thước nhỏ qua hệ thống lọc bụi túi với hiệu suất 95%-99%.
Tháp hấp thụ:
Khí thải được chuyển vào tháp hấp thụ, tiếp xúc với dung dịch làm sạch. Từ đó, tạp chất gây ô nhiễm không khí sẽ được hấp thụ, trộn lẫn với dung dịch và được loại bỏ ra ngoài.
Các loại khí axit trong khói thải lò hơi đốt rác thải bao gồm hydro clorua (HCI), halide halogene (clo, flo, brom, iot, vv), oxit lưu huỳnh (SOx), oxit nitơ (NOx), oxit cacbon (COx)… chủ yếu xuất phát từ sự phân hủy chất thải clo trong chất thải rắn đô thị.
• SOx xuất phát từ quá trình oxy hóa ở nhiệt độ cao của lưu huỳnh – chứa trong chất thải rắn đô thị.
• NOx có nguồn gốc từ quá trình oxy hóa của các hợp chất nitơ và 02 trong các thành phần rác thải sinh hoạt.
• COx từ việc đốt nhiên liệu hữu cơ trong chất thải hộ gia đình hoặc từ quá trình cháy không đầy đủ.
Phương Pháp Xử Lý NOx:
Tác hại:
Oxit Nitơ đều có độc tính, đặc biệt có độc tính cao nhất kể đến là NO2 , khi chỉ tiếp xúc với nó trong vài phút với nồng độ NO2 trong không khí 5 phần triệu thì đã có thể gây ảnh hưởng xấu đến phổi, nếu tiếp xúc vài giờ liền với không khí có nồng độ NO2 khoảng 15-20 phần triệu sẽ có thể gây nguy hiểm cho phổi, tim và gan; nếu nồng độ NO2 trong không khí đạt mức 1% có thể gây tử vong trong vài phút.
1. Hấp thụ khí NOx bằng nước
Trong công nghiệp các loại khí thải có chứa Oxit Nitơ với nồng độ khí thấp thường được xử lý bằng phương pháp hấp thụ bằng nước trong các loại thiết bị như ống Venturi, thiết bị sục khí sủi bọt, Scrubơ, vv… Hiệu quả quá trình thường không cao, tối đa đạt 50%.
Khi hấp thụ NO2 bằng nước một phần axit nitric được sinh ra ở pha khí:
3NO2 + H2O  2HNO3 + NO + Q
2HNO3 + NO + Q
Để xử lý các oxit nitơ bị hấp thụ trong dung dịch, có thể sử dụng dung dịch oxi già loãng. Và bằng cách chưng cất sản phẩm thu được sẽ là HNO3 và H2O để tái sử dụng làm chất hấp thụ.
NO + H2O2 → NO2 + H2O
NO2 + H2O → 2HNO3 +NO
N2O3 + H2O2  N2O4 + H2O
N2O4 + H2O
N2O4 + H2O  HNO3 + HNO2
HNO3 + HNO2
Yếu tố cơ bản để xác định hiệu quả kinh tế của quá trình là lượng chất oxi già (H2O2) (vào khoảng 6kg/tấn axit). Để thúc đẩy quá trình này, ta có thể dùng chất xúc tác. Hiệu quả xử lý có thể đạt 97%
2. Hấp thụ bằng kiềm
Người ta sử dụng nhiều dung dịch kiềm và muối khác nhau. Dây là phương pháp rẻ tiền và mang lại hiệu quả xử lý rất cao.
Hấp thụ hóa học NOx bằng dung dịch Soda được diễn ra theo phương trình phản ứng sau:
2NO2 + Na2CO3 → NaNO3 +CO2 + Q
3. Hấp thụ chọn lọc
Để hấp thụ riêng NO khi không có O2 trong pha khí, ta sẽ sử dụng các dung dịch FeSO4, FeCl2, Na2S2O2 vàNaHCO3.
Phương trình phản ứng tạo thành các phức, diễn ra như sau:
FeSO4 +NO  Fe(NO)SO4
Fe(NO)SO4
FeCl2 + NO  Fe(NO)Cl2
Fe(NO)Cl2
2Na2S2O3 + 6NO → 3N2 + 2na2So4 + 2SO2
2NaHSO3 + 2NO → N2 + 2NaHSO4
2(NH2)2CO + 6NO → 5N2 + 4H2O + 2CO2
4. Khử oxit nitơ có xúc tác và nhiệt độ cao
Quá trình diễn ra khi tiếp xúc NOx với khí khử trên bề mặt xúc tác.
Chất khử thường được dùng là khí metan, khí tự nhiên hay khí than hoặc khí dầu mỏ, CO, H2 hoặc hỗn hợp nitơ-hydro. Hiệu quả khử NOx sẽ phụ thuộc hoạt tính của chất xúc tác.
Xúc tác trên cơ sở platin kim loại xảy ra khi vận tốc thể tích của khí đạt (2-12)x104 l/h cho phép đạt nồng độ còn lại trong khí của NOx là 5×10-4 – 5×10-2 % thể tích.
Bản chất quá trình khử được biểu diễn bằng các phản ứng sau:
4NO + CH4 → 2N2 + CO2 + 2H2O
2NO2 + CH4 → N2 + CO2 + 2H2O
2NO + 2CO → N2 + 2CO2
2NO2 + 4CO → N2 +4CO2
Trên thực tế người ta thường sử dụng khí tự nhiên để xử lý khí NOx bởi lẽ nó dễ kiếm và rẻ.
Phương pháp này đã được ứng dụng để xử lý khí NOx trong sản xuất axit nitric, khí thảỉ chứa (% thể tích): NOx – 0,05÷0,1, N2 – 96,0÷96,2, O2 – 2,2÷3,0.
5. Khử NOx với xúc tác chọn lọc
Quá trình diễn ra các phản ứng tỏa nhiệt sau:
6NO + 4NH3 → 5N2 + 6H2O
6NO2 + 8NH3 → 7N2 +12H2O
8NO +2NH3 → 5N2O + 3H2O
5NO2 + 2NH3 → 7NO + 3H2O
4NO + 4NH3 +O2 → 4N2 + 6H2O
4NH3 + 3O2 → 2N2 + 6 H2O
Quá trình yêu cầu thiết bị đơn giản, hiệu suất xử lý cao và đã áp dụng vào thực tiển.
6. Phân hủy NOx bằng chất khử dị thể
Tại nhiệt độ 500 đến 1.300oC thì sự phân hủy NOx có thể diễn ra trên vật liệu dạng rắn có chứa cacbon như là than đá, than cốc hoặc grafit. Trong đó cácbon đóng vai trò xúc tác và là nhiên liệu đốt.
C +NO → (C – 0) + 0,5N2
(C – O) + NO → CO2 +0,5 N2
Tại nhiệt độ 800oC, độ chuyển hóa NOX khi dùng than cốc là 96% và ở tại nhiệt độ 1000oC thì hiệu suất này tiến đến gần 100%.
7. Phân hủy NOx bằng chất khử đồng thể và dị thể không có xúc tác
Tại nhiệt độ 30 – 40oC sẽ diễn ra các phản ứng tỏa nhiệt sau:
- NH3 + H2O
 NH4OH
NH4OH - 2NO2 + 2NH4OH → NH4NO2 + NH4NO3 + H2O
- N2O3 + 2NH4OH → 2NH4NO2 + H2O
Sự đun nóng dòng khí tiếp theo dẫn đến sự phân hủy các loại acrosol nitric và nitrat tạo thành những sản phẩm không độc.
- NH4NO2 → N2 + 2H2O
- NH4NO3 → N2 + 2H2O +1/2 O2
Khi sử dụng cacbanic ở dạng dung dịch với nước hoặc tác dụng với axit HNO3, H2PO4, H3PO4 sẽ làm giảm nhiệt độ do phân hủy. Tuy nhiên, phương pháp này áp dụng với vận tốc không lớn và hiệu quả làm sạch sẽ không quá 80%.
Dùng dung dịch nước – cacbanic:
- NO2 + H2O → HNO3 +HNO2
- 2HNO2 + CO(NH2)2 → 2N2 + CO2 + 3H2O
- N2O3 + CO(NH2)2 → 2N2 + CO2 + 2H2O
Dùng dung dịch axit nitric – cacbanit
- NO + NO2 + HNO3 + 2CO(NH2)2 → 2N2 + NH4NO3 + 2CO + H2O
Cacbanit được dùng chủ yếu ở dạng bột hoặc hạt, đôi khi chúng được phủ lên các chất mang xốp hoặc được ép cùng với nó.
Hiệu quả xử lý NOx có thể đạt 85 – 99% và lớn hơn.
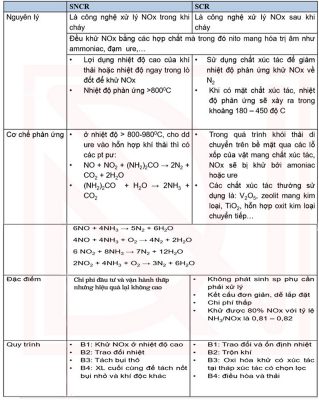
Sau đay là bảng so sánh công nghệ xử lý khí NOx bằng SCR với SNCR:
Phương Pháp Xử Lý Khí SO2:

Tác hại:
Khí Sunfu Đioxit (SO2) là loại chất ô nhiễm phổ biến nhất trong sản xuất công nghiệp cũng như trong sinh hoạt của con người. Nguồn phát sinh ra SO2 có thể là do quá trình đốt bất cứ thứ thứ gì trong cuộc sống hàng ngày (than đá, khí, gỗ và các chất hữu cơ khác như phân khô, rơm rác…), hay trong quá trình công nghiệp (đốt lò hơi, nhiệt điện, luyện kim, hóa chất…). Theo Cơ quan Năng lượng Quốc tế (IEA), đến năm 2017, nhu cầu tiêu thụ than đá và dầu mỏ thế giới tương ứng lần lượt là 4,32 tỷ tấn than và 4,4 tỷ tấn dầu. Khi thành phần lưu huỳnh trong nhiên liệu trung bình chiếm 1% thì lượng khí S02 thải vào khí quyển là 60 triệu tấn/năm. Đó là chưa kể đến lượng SO2 thải ra từ các ngành công nghiệp khác.
Khi nhiễm độc khí SO2, SO2 sẽ đi vào phổi và vào hệ thống bạch huyết. Trong máu SO2 tham gia nhiều phản ứng hoá học để làm giảm dự trữ kiềm, làm cho rối loạn quá trình chuyển hoá đường và protêin, kiến thiếu vitamin B và C, tạo ra methemoglobine gây tắc nghẽn mạch máu và làm giảm khả năng vận chuyển ôxy của hồng cầu, gây co hẹp dây thanh quản, khó thở.
Hiện nay, khí SO2 phát sinh ngày càng nhiều dẫn đến hệ quả là môi trường không khí ngày càng bị ô nhiễm, vì vậy chúng ta cần phải có biện pháp xử lý khí SO2 hiệu quả. Và đây là một trong những phương pháp được sử dụng khá rộng rãi trong các quá trình xử lý khí thải.
Hấp thụ khí SO2 bằng nước:
Hấp thụ khí SO2 bằng nước là một trong những phương pháp đơn giản được áp dụng sớm nhất để loại bỏ khí SO2 trong khí thải, nhất là trong khói thải các loại lò công nghiệp.
Hệ thống xử lý khí SO2 bằng nước bao gồm 2 giai đoạn:
- Hấp thụ khí thải chứa SO2 bằng cách phun nước vào trong dòng khí thài hoặc cho khí thải đi qua một lớp vật liệu đệm (vật liệu rỗng) có tưới nước – scrubơ;
- Giải thoát khí SO2 ra khỏi chất hấp thụ để tái sử dụng nước sạch và thu hồi SO2 (nếu cần).
Nồng độ hòa tan của khí SO2 trong nước giảm khi mà nhiệt độ nước tăng cao, vì vậy nhiệt độ của nước cấp vào hệ thống dùng để hấp thụ khí SO2 phải đủ thấp. Còn để tái sử dụng nước, giải thoát khí SO2 khỏi nước thì nhiệt độ của nước phải cao. Cụ thể là khi ở nhiệt độ 100°c thì SO2 bay hơi ra một cách hoàn toàn và trong dòng khí thoát ra sẽ có lẫn cả hơi nước. Và bằng phương pháp ngưng tụ người ta sẽ thu được khí SO2 với độ đậm đặc rất cao s= 100% để dùng vào mục đích sản xuất axit sunfuric.
Thực tế , lượng nước dùng phải lớn hơn một ít so với lượng nước lý thuyết vì khi nước sau khi ra khỏi thiết bị hấp thụ , luôn không thể đạt mức bão hòa khí SO2 trong nó.
Khi giải hấp thụ thì cần phải đun nóng một lượng nước rất lớn tức phải cần có một nguồn cấp nhiệt (hơi nước) công suất lớn. Đây là một khó khăn. Ngoài ra, nếu muốn sử dụng lại nước cho quá trình hấp thụ thì nước đó phải được làm nguội xuống gần 10°c – tức phải cần đến nguồn cấp lạnh. Đây cũng là vấn đề không đơn giản và rất tốn kém.
Từ các nhược điểm nói trên, phương pháp hấp thụ khí SO2 bằng nước này chỉ áp dụng được khi:
- Nồng độ ban đầu của khí thải có nồng độ SO2 tương đối cao;
- Khi có sẵn nguồn cấp nhiệt (hơi nước) với giá rẻ;
- Khi có sẵn nguồn nước lạnh;
- Có thể xả được nước thải thứ cấp có chứa tương đối nhiều axit ra sông ngòi.
Trường hợp khí thải chứa nhiều SO2 như trong công đoạn nấu quặng sunfua kim loại của công nghiệp luyện kim màu chẳng hạn, nồng độ SO2 trong khí thải có thể đạt 2 – 12%, người ta có thể xử lý khí SO2 bằng nước kết hợp với quá trình oxy hóa SO2 bằng chất xúc tác.
Quá trình cũng được thực hiện thành hai giai đoạn. Giai đoạn thứ nhất: khí S02 kết hợp vãi oxy nhờ sự có mật của chất xúc tác vanađi (V) để biến thành anhiđrit sunfuric SO3 và giai đoạn thứ hai là dùng nước tưới trong scrubơ dể anhiđrit sunfuric kết hợp với nước tạo thành axit sunfuric H2SO4.
Trong giai đoạn thứ nhất, phản ứng oxy hóa khí SO2 có tỏa nhiệt và phản ứng xảy ra càng mạnh ở nhiệt độ càng thấp, do đó cần thực hiện quá trinh này qua nhiều tầng xúc tác, sau mỗi tầng đều được làm nguội.
Hấp thụ khí SO2 bằng đá vôi (CaCO3) hoặc vôi nung (CaO)
Trong đó, phương pháp hấp thụ với dung dịch hấp thụ là Ca(OH)2 hiệu suất xử lý của quá trình có thể lên đến 85 – 90% trong việc loại bỏ SO2. Và đây là một trong những phương pháp được sử dụng khá rộng rãi trong các quá trình xử lý khí thải.
Phương pháp hấp thụ xử lý khí thải chứa SO2 diễn ra như sau:
- Khí thải đi qua hệ thống xử lý- Tháp hấp thụ từ dưới lên, trong đó chất ô nhiễm như SO2 và bụi bẩn sẽ bị giữ lại, không khí sạch đi lên trên và thoát ra ngoài.
- Dung dịch hấp thụ (thường là Ca(OH)2) được hệ thống ống dẫn, bơm tuần hoàn bơm lên phần trên thân trụ và được phun ra bởi hệ thống dàn phun sương, tưới đều dung dịch hấp thụ trong tháp.
- Dòng khí đi từ dưới lên, dòng lỏng từ trên xuống và chúng tiếp xúc với nhau, khi đó quá trình hấp thụ được diễn ra, SO2 bị giữ lại trong dung dịch hấp thụ, không khí sạch thoát ra ngoài.
- Quá trình hấp thụ diễn ra theo phương trình như sau:
- 2SO2 + Ca(OH)2 → Ca(HSO3)2
- Ca(HSO3)2 + Ca(OH)2 → 2CaSO3 + 2H2O
- CaSO3 là chất rắn ít tan nên dễ dàng lắng xuống đáy tháp và được đem đi xử lý bằng cách chôn lấp.
- Khí sạch ra ở đỉnh tháp được tách ẩm, sau đó được đưa ra ngoài môi trường.
Một loại hệ thống xử lý khí SO2 bằng sữa vôi hiện đại hơn được áp dụng ở Nhật Bản. Trong hệ thống này sản phẩm cuối cùng thu được là thạch cao thương phẩm.
Phương pháp magiê oxit (MgO)
Về việc sử dụng sữa MgO để khử SO2 trong khói thải đã được biết đến từ lâu, nhưng việc nghiên cứu ứng dụng trong công nghiệp mới được thực hiện giai đoạn gần đây chủ yếu là do các nhà khoa học – công nghệ của Liên Xô cũ.
SO2 sẽ được hấp thụ bởi MgO để tạo thành tinh thể ngậm nước sunfit magiê. Ở thiết bị hấp thụ sẽ xảy ra các phản ứng sau:
- MgO + SO2 →MgSO3
- MgO + H2O →Mg(OH)2
- MgSO3 + H2O + SO2 →Mg( HSO3)2
- Mg(OH)2 + Mg( HSO3)2 →2MgSO3 + 2H2O
Do độ hòa tan của sunfit magiê trong nước là có giới hạn, nên lượng dư ở dạng MgSO3.6 H2O và MgSO3.3 H2O rơi xuống thành cặn lắng.
Trong dung dịch hấp thụ, tỉ lệ rắn : lỏng trong huyền phù là 1:10; độ pH ở dung dịch hấp thụ đầu vào là 6,8-7,5; còn ở đầu ra là 5,5-6,0 Sunfat magiê được hình thành nhờ sự oxit hóa sunfit magiê.
- MgSO3 + O2→ MgSO4
Việc hình thành MgSO4 không có lợi cho sự tái sinh MgO (nhiệt độ phân hủy MgSO4là 1.200-11.300 oC). Do đó, ta cần hạn chế phản ứng này bằng cách giảm bớt thời gian tiếp xúc giữa 2 pha khí và pha lỏng hoặc dùng chất làm giảm tính oxi hóa.
Tái sinh Magiê sẽ được thực hiện trong lò nung ở to = 900oC và cho thêm than cốc .
Khi nung như vậy thì khí SO2 thoát ra có nồng độ là 7-15%. Khí sẽ được làm nguội , tách bụi và sương mù axit sunfuric rồi đưa đi sản suất axit sunfuaric.
Trong đó các phương pháp chúng ta có thể xử lí theo là:
- Magiê oxit kết hợp với potos ( kali cacbonat )
- Magiê oxit không kết tinh
- Magiê sủi bọt
- Magiê oxit “kết tinh” theo chu trình
Ưu điểm của phương pháp magiê oxit:
Có thể xử lí khí nóng không cần làm nguội sơ bộ .Sản phẩm thu được sẽ tận dụng sản xuất axit sunfuric. MgO dễ kiếm và rẻ tiền , hiệu quả xử lí cao.
Phương pháp kẽm
Xử lí khí thải SO2 bằng kẽm oxit ( ZnO ) cũng tương tự như là phương pháp dùng oxit magiê tức là sử dụng phản ứng giữa SO2 với kẽm oxit để thu các muối sunfit và bisunfit, sau đó sẽ dùng nhiệt để phân ly thành SO2 và ZnO.
Ở phương pháp này, chất hấp thụ là kẽm. Phản ứng hấp thụ như sau:
- SO2 + ZnO + 2,5 H2O→ ZnSO3. + 2,5 H2O
Và khi nồng độ SO2 lớn
- 2SO2 + ZnO + H2O →Zn(HSO3)2
Sunfit kẽm tạo thành không tan trong nước sẽ bị tách ra bằng xyclon ướt và sấy khô.Việc tái sinh ZnO được thực hiện bằng cách nung sunfit ở 350oC.
- ZnSO3.2,5 H2O→ SO2 + ZnO + 2,5H2O
SO2 được sử dụng để tiếp tục chế biến còn ZnO sử dụng lại hấp thụ.
Có các phương pháp sau:
- Phương pháp dùng kẽm oxit đơn thuần
- Phương pháp dùng kẽm oxit kết hợp với natri sunfit
Ưu điểm của phương pháp kẽm oxit :
Là quá trình phân ly kẽm sunfit ZnSO3 thành SO2 và ZnO xảy ra ở nhiệt độ thấp hơn đáng kể so với quá trình phân ly bằng nhiệt đối với MgSO3.
Có khả năng xử kí khí cao ở nhiệt độ (200-250oC)
Nhược điểm:
Có khả năng hình thành sunfit kẽm (MgSO4) làm cho việc tái sinh ZnO bất lợi về kinh tế nên phải thường xuyên tách chung ra và bổ sung ZnO.
Xử lý SO2 bằng Amoniac
SO2 được hấp thụ trong dung dịch amoniăc hoặc dùng dung dịch sunfit – bisunfit amon.
Vì amoniăc và khí SO2 trong dung dịch nước sẽ có phản ứng với nhau và tạo thành muối trung gian amoni sunfit, sau đó muối amoni sunfit lại tác dụng tiếp với SO2 và H2O để tạo ra muối amoni bisunfit, theo các phản ứng sau:
- NH4 + H2O + SO2 → (NH4)2 SO3
- H2O + SO2 + (NH4)2SO3 → 2NH4HSO3
- 2NH4HSO3 nung nóng (NH4)2SO3 + H2O + SO2
Có thể : 2NH4HSO3 + (NH4)2 SO3 → 2(NH4)2SO4 + S + H2ONH4)2 SO3 + S→ (NH4)2 S2O3
- (NH4)2 S2O3 + 2NH4HSO3 → 2(NH4)2 SO4 + 2S + H2O
Lưu huỳnh đơn chất sẽ tiếp tục tác dụng với sunfit. Cứ như vậy thì tốc độ phản ứng phân hủy dung dịch làm việc sẽ tăng dần, dung dịch làm việc sẽ hoàn toàn biến thành amoni sunfat và lưu huỳnh đơn chất.
Các biện pháp xử lí khí theo amoniăc như sau:
• Xử lí khí SO2 bằng amoniăc và vôi
• Hệ thống xử lí khí SO2 bằng amoniăc theo chu trình
• Xử lí khí SO2 bằng amoniăc có chưng áp
* Ưu điểm của phương pháp amoniăc:
Hiệu quả cao, chất hấp thu dễ kiếm và thu được sản phẩm cần thiết ( sunfit và bisunfit amon).
Xử lí khí SO2 bằng các chất hấp thụ hữu cơ
Trong xử lí khí SO2 có trong khí thải bằng các chất hấp thụ hữu cơ được áp dụng ở nhiều trong công nghiệp luyện kim màu. Chất hấp thụ khí SO2 đã được sử dụng phổ biến là các amin thơm chẳng hạn như anilin, toluđin, xyliđin, và đimety-anilin.
Quá trình xử lí theo phương pháp trên là:
• Quá trình xử lý khí SO2 bằng dimetylanilin – Quá trình ASARCO.
Quá trình này đã được nghiên cứu và áp dụng tại nhiều các nhà máy luyện kim.
• Quá trình sunfidin
Quá trình này được áp dụng tại các hãng công nghiệp hóa chất và luyện kim của Đức, nghiên cứu và áp dụng tại nhà máy luyện kim Hamburg để khử SO2 trong luồng khói thải của lò thổi luyện đồng. Nồng độ của khí SO2 trong khói thải dao động trong phạm vi 0,5-8%, trung bình là 3,6%.Chất hấp thụ là hỗn hợp của xylidin và nước tỉ lệ ≈ 1:1.
Xử lí khí SO2 bằng các chất hấp phụ thể rắn
Do quá trình xử lý khí SO2 bằng chất hấp thụ theo phương pháp ướt có nhược điểm là nhiệt độ của khí thải sẽ bị hạ thấp, độ ẩm nếu tăng cao lại gây han rỉ thiết bị máy móc, hệ thống xử lý cồng kềnh. Để khắc phục các yếu điểm trên và có thể vừa hoàn nguyên vật liệu hấp phụ vừa làm sạch khí thải khỏi bụi của vật liệu hấp phụ người ta đã kết hợp giữa quá trình khô và ướt. Đây là biện pháp ngày càng trở nên thiết thực.
• Hấp phụ khí thải chứa SO2 bằng than hoạt tính
• Xử lí khí thải chứa SO2 bằng than hoạt tính có tưới nước- Quá trình LURGI
• Xử lí khí thải chứa SO2 bằng nhôm oxit kiềm hóa
• Xử lí khí thải chứa SO2 bằng mangan oxit (MnO)
• Xử lí khí SO2 bằng vôi và dolomit trộn vào than nghiền
Hai loại thiết bị được sử dụng là thiết bị tạo bọt và thiết bị lọc ướt có vật liệu đệm lọc với vật liệu đệm sơ sợi hoặc vật liệu đệm là các vòng sứ được chọn vì các lí do:
- Có hiệu suất cao.
- Dễ vận hành
- Chịu được nhiệt độ cao.
- Có khả năng hấp thụ các hơi khí độc hại.
- Có khả năng làm nguội khói thải.
- Lọc được các hạt bụi nhỏ.
Phương Pháp Xử Lý Khí CO2:

Tác hại:
CO có ái lực mạnh với hồng cầu (hemoglobin) trong máu tạo ra cacboxyl hemoglobin (COHb). Ái lực này của CO lớn hơn 200 lần ái lực của O2 với hồng cầu làm giảm khả năng vận chuyển O2 của máu. Khi nồng độ CO trong không khí bên ngoài và thời gian tiếp xúc với hàm lượng CO tăng dần sẽ dẫn đến hàm lượng COHb tăng dần. Ban đầu khi COHb tăng đến 2-5 % thì hệ thống thần kinh trung ương bắt đầu bị ảnh hưởng. Khi COHb tăng đến 10-20 % thì chức năng hoạt động của các cơ quan khác nhau trong cơ thể bị tổn thương. Nếu hàm lượng COHb tăng đến 60 % tương ứng với hàm lượng CO trong không khí bên ngoài là là 1000 ppm thì tính mạng bị nguy hiểm và có thể dẫn đến tử vong. Nồng độ CO trung bình năm tại trạm Láng, Hà Nội trong năm 2003 là 1 ppm3.
Tính chất của các phương pháp xử lý khí CO2:
Điôxít cacbon là khí không màu, không mùi.
Tỷ trọng riêng của CO2 ở 25 °C là 1,98 kg m-3 nặng hơn không khí. Phân tử điôxít cacbon (O=C=O) chứa hai liên kết đôi và có hình dạng tuyến tính.
Ở nhiệt độ dưới -78 °C, điôxít cacbon ngưng tụ lại thành các tinh thể màu trắng gọi là băng khô. Điôxít cacbon lỏng chỉ được tạo ra dưới áp suất trên 5,1 bazo; ở điều kiện áp suất khí quyển, CO2 chuyển trực tiếp từ pha khí sang rắn hay ngược lại gọi là quá trình thăng hoa.
Nước hấp thụ một lượng nhất định điôxít cacbon, khoảng 1% điôxít cacbon hòa tan chuyển hóa thành axit cacbonic.
Axít cacbonic phân ly một phần thành các ion HCO3 và CO3 2-.
Phương pháp xử lý khí CO2 Hấp thụ bằng dung dịch etanolamin:
- 2RNH2 + CO2 + H2O → (RNH3)2CO3
- (RNH3)2CO3 + CO2 → NH3HCO3
- 2RNH2 +CO2→ RNHCOONH3R
Dung dịch hấp thụ được phục hồi bằng cách nung nóng
- Ưu điểm: giá thành rẻ, khả năng phản ứng của khí cao , dễ ổn định và phục hồi.
- Nhược điểm: áp suất hơi của dung dịch hơi cao , dung dịch khi phản ứng không thuận nghịch với khí CO2
Phương pháp xử lý khí CO2 Hấp thụ bằng dung dịch amoniac:
Quá trình hấp thụ của khí:
- NH3 +CO3 →NH3COONH3
- NH3 +CO2 +H2O→2NH3HCO3
- NH3 +CO2 +H2O→ (NH4)2CO3
Áp dụng việc xử lý khí chứa 30% CO2.
- Ưu điểm: cho phép giảm nồng độ khí CO2 từ 34% xuống còn 0.015% trong khi tổng hợp NH3
- Nhược điểm: dung dịch NH3 rất dễ giải phóng khí NH3.
Các phương pháp xử lý khí CO2 Hấp thụ bằng nước
- Phương pháp xử lý khí CO2 bằng nước là một phương pháp khá đơn giản và được áp dụng sớm nhất để loại CO2 ra khỏi khí thải. Bằng cách phun nước vào dòng khí hoặc cho khí CO2 đi qua lớp vật liệu đệm có tưới nước.
- Ưu điểm: Nguyên liệu rẻ , dễ tìm kiếm và hoàn nguyên được .
- Nhược điểm: Độ hòa tan của CO2 trong nước thường thấp , phải cần một lượng nước rất lớn, thiết bị phải có thể tích lớn, dễ xảy ra quá trình nhả hấp thụ.
Hấp thụ CO2 bằng huyền phù CaCO3( sữa vôi Ca(OH)2 )
Phương pháp xử lý khí CO2 bằng sữa vôi là một trong những phương pháp được áp dụng rộng rãi trong các ngành công nghiệp do việc hiệu quả xử lý của khí rất cao, nguyên liệu rất rẻ tiền và có sẵn ở nhiều nơi.
- Ca(OH)2 + CO2 →CaCO3 + H2O
- CaO + CO2 → CaCO3
- Ưu điểm: quy trình công nghệ đơn giản, chi phí cho các hoạt động thấp, chất hấp thụ dễ tìm kiếm , có khả năng xử lý khí CO2 mà không cần quá trình làm nguội và xử lý sơ bộ, có thể chế tạo thiết bị bằng vật liệu thông thường, không cần các vật liệu chống ăn mòn ( axit) và nó không cần chiếm nhiều diện tích xây dựng .
- Nhược điểm: thiết bị dễ đóng cặn vì việc tạo thành CaCO3, sẽ gây ra tắc các đường ống và ăn mòn các thiết bị có liên quan.
Hấp thụ CO2 bằng dung dịch kiềm:
Thường sử dụng chất hấp thụ là NaCO3, phản ứng hấp thụ sẽ diễn ra như sau:
- Na2CO3 + CO2 + H2O → NaHCO3
Vận tốc hấp thụ nhỏ vì vậy để tăng vận tốc hấp thụ thì người ta phải dùng chất xúc tác là methanol, etanol, đường ….
- Dung dịch sẽ được phục hồi bằng cách nung nóng bằng hơi nước.
- Nhược điểm: Hiệu quả của việc hấp thụ thấp và tốn rất nhiều hơi nước để phục hồi dung dịch.
- Để việc tăng hiệu quả hấp thụ thì người ta sẽ cho vào dung dịch một lượng dư NaOH, dung dịch sau khi hấp thụ không được tái sinh mà sẽ được sử dụng vào các mục đích khác.
Phương pháp xử lý khí CO2 bằng hấp phụ:
Hấp phụ là sự lôi cuốn các phần tử vật khí , hơi bởi các bề mặt chất rắn. Ứng dụng phương pháp hấp phụ là để làm sạch khí có hàm lượng tạp chất khí và hơi nhỏ.
Trong công nghiệp ta thường tiến hành quá trình hấp phụ để làm sạch và sấy khô không khí , tách các hỗn hợp khí thành từng phần tử , tiến hành quá trình xúc tác dị thể trên bề phân chia pha.
Hấp phụ gồm: hấp phụ vật lý và hấp phụ hóa học
Hấp phụ vật lý của các phương pháp xử lý khí CO2:
- Lực hấp phụ Vander Waals đây là hiện tượng tương táccủa quá trình thuận nghịch giữa các lực hút với các phân tử của chất rắn và các chất bị hấp phụ.
- Quá trình hấp phụ là quá trình thuận nghịch xảy ra hoàn toàn.
- Nhiệt tỏa ra là không đáng kể.
- Có thể hấp phụ bằng nhiều lớp hay một lớp.
Hấp phụ hóa học của các phương pháp xử lý khí CO2:
- Là kết quả giữa sự tương tác hóa học với chất rắn và chất bị hấp phụ.
- Nhiệt phát ra trong quá trình hấp phụ hóa học thường có nhiệt độ phản ứng lớn.
- Quá trình thường xảy ra là quá trình không thuận nghịch .
Áp dụng của hấp phụ của các phương pháp xử lý khí CO2:
Trong các ngành công nghiệp hóa chất , thực phẩm, quá trình hấp phụ thu thường dùng để:
- Thu hồi các cấu tử trong các pha khí
- Làm sạch trong các pha khí
- Tách hỗn hợp để tạo thành các cấu tử riêng biệt
- Tạo thành một dung dịch sản phẩm.
Lựa chọn dung môi của các phương pháp xử lý khí CO2:
Nếu dung môi của quá trình là tách các cấu tử hỗn hợp khí đó, thì việc lựa chọn dung môi tốt thường phụ thuộc vào các yếu tố :
- Độ hòa tan tốt : có tính chọn lọc có ý nghĩa chỉ hòa tan những cấu tử cần tách và hòa tan không đáng kể các cấu tử còn lại . Đây là một trong những điều kiện quan trọng nhất.
- Độ nhớt của dung môi:Độ nhớt càng bé thì trở lực quá trình càng nhỏ dẫn đến sẽ làm tăng tốc độ hấp thu và có lợi cho quá trình truyền khối.
- Nhiệt dung riêng : Nhiệt dung riêng càng bé thì sẽ tốn ít nhiệt khi cần hoàn nguyên dung môi.
- Nhiệt độ sôi: khác xa với nhiệt độ sôi của các chất hòa tan khác, nhiệt độ sôi của quá trình hấp phụ sẽ dễ tách các cấu tử ra khỏi dung môi.
- Nhiệt độ đóng rắn : thấp nhằm tránh tắc thiết bị , không tạo các quá trình kết tủa , không độc và có thể thu hồi các cấu tử hòa tan dễ dàng hơn.
- Thường ít bay hơi, rẽ tiền , dễ kiếm và không độc hại với sức khỏe con người và không ăn mòn các thiết bị.
Tháp Hấp Thụ Khô Và Ướt:
Khí thải phát sinh từ các quá trình công nghiệp thường chứa các thành phần có hại cho môi trường. Bởi vì điều này, các cơ sở được yêu cầu phải có biện pháp để loại bỏ các chất gây ô nhiễm trước khi khí được thải vào bầu khí quyển.
Có 2 dạng tháp hấp thụ:
#1. PHƯƠNG PHÁP XỬ LÝ KHÍ THẢI DẠNG ƯỚT (HẤP THỤ)
Phương pháp xử lý khí thải dạng ướt là một trong những phương pháp kiểm soát ô nhiễm hiệu quả và chi phí hợp lý nhất. Trong thực tế, phương pháp này có khả năng loại bỏ hơn 99% chất ô nhiễm trong dòng khí thải và loại bỏ được bụi có kích thước nhỏ hơn 3 µm.
Bản chất của phương pháp này là “truyền khí ô nhiễm qua một chất lỏng phù hợp để loại bỏ các chất gây ô nhiễm”. Chất lỏng có thể tích điện dương hoặc tích điện âm và khác nhau về thành phần hóa học để đảm loại bỏ các chất gây ô nhiễm hiệu quả nhất.
Hiệu quả của quá trình phụ thuộc vào:
Diện tích bề mặt của chất lỏng có tác động đáng kể đến hiệu quả tổng thể của phương pháp ướt.
Mức độ chất lỏng được trộn lẫn với dòng khí đi vào
Do sử dụng chất lỏng nên phương pháp này thường phát sinh nước thải và dòng mù, hơi nước thoát ra ống khói. Tùy theo mức độ, công suất mà có hoặc không yêu cầu các biện pháp xử lý nước thải hoặc loại bỏ mùi, hơi nước trước khi dòng khí đi ra khỏi thiết bị. Một số dạng thiết bị thường gặp trong phương pháp xử lý khí thải ướt như sau:
#2. PHƯƠNG PHÁP XỬ LÝ KHÍ THẢI DẠNG KHÔ (HẤP PHỤ)
Ngược lại, các phương pháp xử lý khí thải dạng khô nhằm loại bỏ các chất gây ô nhiễm từ khí thải mà không cần sử dụng chất lỏng. Thay vào đó, phương pháp này sử dụng vật liệu phản ứng khô được gọi là “chất hấp phụ”. Chẳng hạn như bùn kiềm, chúng chủ yếu được thực hiện để loại bỏ axit khỏi dòng khí thải.
Cũng như phương pháp ướt thì diện tích bề mặt là rất quan trọng, vì vậy dòng khí thải được truyền qua các lớp hấp thụ để tối đa hóa hiệu quả xử lý. Phương pháp xử lý khí thải dạng khô thường bao gồm một vật liệu/chất tạo điều kiện cho việc loại bỏ các chất ô nhiễm trong dòng khí thải.
Trong khi các phương pháp xử lý khí thải khô thường không có khả năng đạt được mức độ loại bỏ chất ô nhiễm tương tự như phương pháp ướt, chúng phù hợp hơn cho các ứng dụng nhất định, đặc biệt là ở các cơ sở không có cơ sở hạ tầng để xử lý nước thải sản xuất. Ngoài ra, phương pháp khô còn có thể hoàn nguyên vật liệu hấp phụ nhằm hạn chế phát thải.
Hậu Qủa Của Việc Không Quan Tâm Đến Khí Thải Trong Sản Xuất Là Gì?
Quý khách vui lòng xem đoạn video sau đây
Công Ty TNHH Dương Nguyễn là đơn vị Tư Vấn – Thiết Kế uy tín lâu năm từng thực hiện nhiều dự án hệ thống lọc bụi công nghiệp, hệ thống hút bụi công nghiệp, hệ thống thu hồi bụi lớn trên toàn quốc. Hãy liên hệ với chúng tôi để được tư vấn thiết kế hệ thống thu hồi bụi hiệu năng cao với giá thành hợp lý nhất.
